ADN polymérase
Une ADN polymérase est un complexe enzymatique intervenant dans la réplication de l'ADN au cours du cycle cellulaire, mais également dans des processus de réparation et de recombinaison de l'ADN.
Recherche sur Google Images :
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Enzyme assurant la polymérisation des désoxyribonucléotides pour la synthèse d'un brin d'ADN, par élongation d'une amorce... (source : pagesperso-orange)
Une ADN polymérase est un complexe enzymatique intervenant dans la réplication de l'ADN au cours du cycle cellulaire, mais également dans des processus de réparation et de recombinaison de l'ADN. Il existe différentes familles de polymérases qui changent selon leurs séquences en acide aminé et leurs propriétés catalytiques.
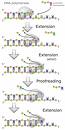
Toutes les ADN polymérases synthétisent l'ADN dans le sens 5'-3' (comme chez les procaryotes) et aucune n'est capable de commencer une nouvelle chaîne sans amorces. Elles ne peuvent que rajouter des nucléotides à partir d'une amorce préexistante à l'extrémité 3'-OH. Pour cette raison l'ADN polymérase a besoin d'une amorce (ou primer), sur laquelle elle pourra ajouter de nouveaux oligonucléotides. L'amorce peut être constituée d'ADN ou d'ARN in vitro et d'ARN in vivo et est synthétisée par une autre enzyme, nommée primase. Une enzyme, hélicase, est ensuite requise pour délier le double brin de l'ADN et ainsi favoriser l'accès des ADN polymérases sur les brins d'ADN, devenu simple brin, et permettre ainsi la réplication. Les ADN polymérases possèdent une structure particulièrement conservée. Elles sont reconnues comme étant des holœnzymes dans la mesure où elles ont besoin d'un ion magnésium comme cofacteur pour fonctionner correctement. En absence d'ions magnésium, elles sont nommées apœnzymes.
Les ADN polymérase ont la capacité de corriger les erreurs dans la formation de brin néoformé. Quand une paire de base incorrecte s'est vu consacrée, l'ADN polymérase va revenir en arrière grâce à son activité 3'-5' exonucléase, va réinsérer la base correcte, et reprendre la réplication.
Cinq ADN polymérases ont été identifiées chez les bactéries :
- Pol I : impliquée dans la réparation de l'ADN. Elle possède les deux activités polymérase 5'→3'et exonucléase 3'→5' (fragment de Klenow), et participe à la synthèse des fragments d'Okazaki. Elle intervient aussi en fin de réplication pour éliminer les amorces d'ARN (activité exonucléase 5'-3').
- Pol II : impliquée dans la réplication de l'ADN endommagé et possède activité 5'→3'.
- Pol III : c'est la principale polymérase bactérienne qui intervient dans l'élongation de la chaîne d'ADN lors de la réplication au niveau du brin avancé et de la synthèse des fragments d'Okazaki. Elle est constituée de dix sous-unités. On définit une structure minimale (core enzyme αεθ) comprenant une sous-unité α (activité polymérase), une sous-unité ε (exonuléase 3'→ 5') et une sous-unité θ de fonction inconnue. Deux cores (αεθ) et un complexe γ (facteur de chargement) sont maintenus ensemble par l'intermédiaire d'un connecteur, la protéine t.
- Pol IV : ADN polymérase de la famille Y.
- Pol V : ADN polymérase de la famille Y.
- ADN Pol α-primase : ce complexe synthétise de courtes amorces ARN à l'origine de la réplication sur le brin avancé mais aussi des amorces ARN pour les fragments d'Okazaki du brin retardé. Cette polymérase ne possède pas de fonction exonucléasique.
- ADN Pol β : Cette polymérase est impliquée dans des processus de réparation de l'ADN. Elle ne possède pas de fonction exonucléasique. Elle correspond à la Pol IV bactérienne.
- Pol γ : Cette polymérase intervient dans la réplication de l'ADN mitochondrial.
- ADN Pol δ : C'est la polymérase principale qui intervient dans la réplication de l'ADN chez les eucaryotes, avec l'ADN Pol ε, dans la synthèse du brin avancé et du brin retardé. Elle possède aussi une activité exonucléasique 3'vers 5'intervenant dans la correction des erreurs et dans des processus de réparation. La polymérase δ est hautement processive quand elle est associée au PCNA. Cette polymérase correspond à la Pol III bactérienne.
- ADN Pol ε : Elle possède une activité polymérase 5'vers 3'et une activité exonucléase 3'vers 5'et intervient dans la réplication et la réparation de l'ADN. Elle lit dans le sens 3'=> 5'et synthétise 5'=> 3'la zone du télomère qui ne peut être synthétisée par l'ADN Pol δ (une amorce préalable doit être posée par la primase sur l'extrémité 3'allongée du télomère). Une ligase recollera ensuite les 2 brins.
- η, ι, κ, et Rev1 : polymérase de la famille Y
- ADN Pol ζ
ADN polymérases chez les Archæa
- Polymérase B : L'ensemble des ADN polymérases de type B identifiées chez les Archæa présentent une activité 5'vers 3'et une activité exonucléasique 3'vers 5'. Elles sont constituées d'une seule sous-unité.
- Polymérase D : Ces ADN polymérases trouvées chez les Euryarchæotes sont constituées de deux sous-unités différentes. La grande sous-unité DP2 possède l'activité catalytique, mais uniquement en présence de la petite sous-unité DP1.
Sur la base d'homologie de séquence protéique et de structure, les polymérases peuvent être divisées en différentes familles : A, B, C, D, X, Y et RT.
Les polymérases de la famille A contiennent des polymérases réplicatives et des polymérases de réparation. Les polymérases réplicatives de cette famille comprennent surtout la polymérase du bactériophage T7 et l'ADN polymérase eucaryote γ. Parmi les ADN polymérases de réparation, on peut trouver l'ADN Polymérase I de E. coli, de Thermus aquaticus et de Bacillus stearothermophilus. Ces polymérases de réparation sont impliquées dans des processus de réparation par excision et dans la synthèse des fragments d'Okazaki du brin retardé lors de la réplication.
Cette famille comprend principalement des ADN polymérases réplicatives et inclut les ADN polymérases majeurs eucaryotes α, δ, et ε. Une ADN polymérase de la famille B a été identifiée chez l'ensemble des espèces d'Archæa examinées. La famille B contient aussi des ADN polymérases provenant de bactéries et de bactériophages, dont les mieux caractérisées sont celles des phages T4 et RB69. Ces enzymes sont impliquées dans la synthèse du brin avancé et du brin retardé.
Les ADN polymérases de cette famille ont été isolées chez des bactéries. Elles possèdent aussi une activité exonucléase 5'->3'.
Les ADN polymérases de la famille D restent toujours peu caractérisées et sont trouvées uniquement chez les Euryarchæota, un groupe d'Archæa.
La famille X comprend l'ADN polymérase β bien caractérisée chez les eucaryotes et d'autres ADN polymérases comme pol σ, pol λ, pol μ. L'ADN polymérase β est indispensable au processus de réparation de l'ADN nommé BER (base excision repair). Pol λ et Pol μ interviennent dans des processus de réparation de l'ADN impliquant des cassures doubles brins.
Les polymérases de la famille Y sont caractérisées par leur capacité à tolérer des lésions de l'ADN lors de la réplication. Elles sont nommées les polymérases de translésion (TLS pour translesion sythesis polymerases). Elles ne possèdent pas de fonction exonucléase 3'vers 5'. Leur fidélité lors de la synthèse d'ADN est faible, même en absence d'ADN endommagé.
La famille des comprend des ADN polymérase de rétrovirus et d'eucaryotes. Ces polymérases sont capables de synthétiser de l'ADN à partir d'une matrice ARN.
- Garg, P. et P. M. Burgers. 2005. DNA polymerases that propagate the eukaryotic DNA replication fork. Crit Rev Biochem Mol Biol 40 :115-28.
- Hubscher, U., G. Maga, et S. Spadari. 2002. Eukaryotic DNA polymerases. Annu Rev Biochem 71 :133-63.
- Kelman, Z. 2000. DNA Replication in the Third Domain (of Life). Current Protein and Peptide Science 1 :139-154.
- Johnson, A., and M. O'Donnell. 2005. Cellular DNA replicases : components and dynamics at the replication fork. Annu Rev Biochem 74 :283-315.
- Nohmi, T. 2006. Environmental Stress and Lesion-Bypass DNA Polymerases. Annu Rev Microbiol.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité