Acide phosphorique
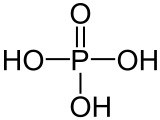
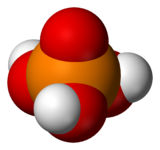
L'acide phosphorique est un oxacide à base de phosphore de formule H 3 PO 4. C'est un triacide. Il intervient fréquemment en minéralogie et a une importance capitale en biochimie.

Catégories :
Composé du phosphore - Produit chimique corrosif - Phosphate - Oxoacide - Saveur acide - Régulateur alimentaire de pH - ADN - Séquestrant
| Acide phosphorique | ||
|---|---|---|
  |
||
| Général | ||
| Nom IUPAC | acide phosphorique | |
| Synonymes | Acide orthophosphorique | |
| No CAS | ||
| No EINECS | ||
| No E | E338 | |
| FEMA | ||
| Apparence | Solide blanc ou liquide visqueux incolore (T>42 °C) | |
| Propriétés chimiques | ||
| Formule brute | H3PO4 | |
| Masse molaire | 97, 9952 g∙mol-1 H 3, 09 %, O 65, 31 %, P 31, 61 %, |
|
| pKa | 2, 12, 7, 21, 12, 67 | |
| Propriétés physiques | ||
| T° fusion | 42 °C[1] | |
| T° ébullition | Se décompose au-dessous du pont d'ébullition à 213 °C[1] | |
| Solubilité | Miscible à l'eau bonne dans les alcools |
|
| Masse volumique | 1.9 g/cm³[1] | |
| Pression de vapeur saturante | à 20 °C : 4 Pa[1] | |
| Précautions | ||
|
|
||
|
||
|
|
||
| Phrases R : 34, | ||
| Phrases S : (1/2), 26, 45, | ||
|
|
||
|
|
||
 |
||
|
|
||
 Danger |
||
| Inhalation | Sensation de brûlure. Toux. Essoufflement. Mal de gorge. | |
| Peau | Rougeur. Douleur. Brûlures cutanées. Ampoules. | |
| Yeux | Douleur. Rougeur. Brûlures profondes graves. | |
| Ingestion | Douleurs abdominales. Sensation de brûlure. Choc ou collapsus. | |
| Composés apparentés | ||
| Autres composés | Acide hypophosphoreux, Acide phosphoreux, Acide pyrophosphorique | |
|
|
||
L'acide phosphorique est un oxacide à base de phosphore de formule H3PO4. C'est un triacide. Il intervient fréquemment en minéralogie et a une importance capitale en biochimie.
L'acide orthophosphorique (o-phosphorique) ou simplement acide phosphorique est un acide minéral obtenu par traitement du minerai de phosphate ou par combustion du phosphore.
À température ambiante, l'acide phosphorique est un solide cristallin de densité 1, 83, qui fond à 42, 35 °C. L'acide phosphorique est généralement stocké et vendu sous forme de solution finale.
Il forme la matière première de base pour la production de phosphates (ou sels phosphatés). Sa formule chimique est H3PO4.
Chimie
Il s'agit d'un polyacide capable de céder trois protons, on l'appelle par conséquent triacide. Il cède trois protons H + pour former les Bases : dihydrogénophosphate, hydrogénophosphate, et orthophosphate :
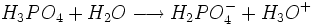
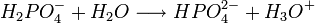
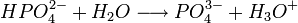
Biologie
Les dimères et trimères de l'acide phosphorique interviennent dans de nombreux domaines en biologie comme les transporteurs d'énergie ADP/ATP, l'ADN et dans les os.
Synthèse industrielle
Pour obtenir l'acide phosphorique, on traite la roche phosphate de calcium par l'acide sulfurique, puis on filtre le liquide résultant pour retirer le sulfate de calcium dihydraté nommé " phosphogypse ". On peut aussi le préparer par calcination de la vapeur de phosphore, puis par traitement de l'oxyde résultant avec de la vapeur.

Utilisations
L'acide phosphorique est particulièrement utilisé en laboratoire, car il résiste à l'oxydation, à la réduction ainsi qu'à l'évaporation.
L'acide phosphorique est employé dans les boissons non alcoolisées comme régulateur de pH (E338) : essentiellement dans les sodas au cola (Coca-Cola, Pepsi Cola) [4].
L'acide phosphorique est employé comme composant des ciments dentaires, comme catalyseur ou dans les métaux inoxydables, et dans la production des phosphates — utilisés dans les adoucisseurs d'eau, les engrais et les détergents.
L'acide phosphorique est fréquemment utilisé en solution dans des produits utilisés en mécanique pour dérouiller les pièces métalliques. Il sert aussi à "phosphater" les pièces pour les protéger de l'oxydantion à l'air libre.
Risques
L'ingestion d'un taux élevé d'acide phosphorique pourrait entraver le fonctionnement des reins et faciliter les calculs rénaux. Des chercheurs américains ont interrogé 465 personnes pour lesquelles une insuffisance rénale avait été récemment diagnostiquée et ont constaté à partir de la description de leur régime alimentaire qu'à partir de deux verres de coca, le risque d'insuffisance rénale est multiplié par deux. Il en est de même avec le coca "light". Par contre, aucune association n'a été trouvée avec les autres sodas, ce qui renforce la suspicion à l'encontre de l'acide phosphorique. [5]
Annexes
Notes et références
- ACIDE PHOSPHORIQUE, fiche de sécurité du Programme Mondial sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ «Acide phosphorique» dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Isabelle Eustache, «Pas de coca, c'est mieux pour les reins !» sur www. e-sante. fr, 23/07/2007. Consulté le 15 mai 2008.
- ↑ Saldana TM, Basso O, Darden R, Sandler DP., «Carbonated beverages and chronic kidney disease. » sur http ://www. ncbi. nlm. nih. gov, 18/07/2007. Consulté le 16 avril 2009.
Liens et documents externes
Recherche sur Google Images : |
|
"La chimie dans la vie courante" L'image ci-contre est extraite du site sciences.physiques.perso.neuf.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (624 x 885 - 112 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité