Hydrogénase
Les hydrogénases sont des enzymes qui catalysent de façon réversible la conversion des protons en dihydrogène selon la réaction ...
Les hydrogénases sont des
2H+ + 2 e - = H2
Il existe deux grandes classes d'hydrogénases : les hydrogénases [NiFe] et les hydrogénases à fer seul. Les sites actifs de ces enzymes sont de nature organométallique et changent entre eux surtout par la nature des métaux qui les composent.
Généralités
En 1887, Hoppe-Seyler découvre que des bactéries peuvent décomposer le formiate en H2 et CO2. Le nom «hydrogénase» est donné par Stevenson et Stickland en 1931 après avoir observé la production d'hydrogène par des bactéries du colon et son utilisation pour diminuer des substrats. Les hydrogénases désignent désormais une classe d'enzyme qui peut catalyser de façon réversible la conversion des protons en hydrogène :
Elles catalysent cette réaction à un potentiel particulièrement proche du potentiel thermodynamique (E°app= –413 mV dans l'eau, à 25 °C, sous 0, 1 bar de H2 et pH 7). Dans ces organismes, l'hydrogène peut avoir deux fonctions.
La première fonction est énergétique : un excédent de pouvoir réducteur peut être éliminé sous forme d'hydrogène.
La seconde fonction métabolique utilise l'hydrogène comme substrat réducteur : réduction du CO2 en méthane chez Methanobacterium , en acide éthanoïque chez Acetobacterium , hydrogénation du fumarate chez Vibrio succinogenes , production de NAD (P) H dans les hydrogénases diaphorases comme chez Ralstonia eutropha ...
Si les hydrogénases sont connues depuis plus d'un siècle, la détermination de leurs structures et surtout celle de leurs sites actifs a suivi un long cheminement :
En 1956, la présence de fer non hémique est confirmée. Au cours des années 1970, des expériences de RPE ont montré que les hydrogénases contenait des clusters fer-soufre de type ferredoxine HiPIP («high potential iron-sulfur protein»). En 1980, Thauer a détecté la présence de nickel dans certaines hydrogénases donnant lieu à de nombreuses spéculations sur la nature du site actif. Il est désormais établi qu'il existe deux principales classes d'hydrogénases, les hydrogénases [NiFe] et les hydrogénases à fer, ainsi qu'une classe apparentée nommée hydrogénases sans cluster fer-soufre ou Hmd. On connaît une centaine d'hydrogénases réparties chez une quarantaine d'organismes.
Les classes d'hydrogénases
Les deux principales classes d'hydrogenases se distinguent par leurs activités mais aussi par leurs sites actifs particulièrement originaux. En effet, la présence de sites organométalliques possédant des ligands cyanure et carbonyle est un fait unique en biologie. Cela est d'autant plus remarquable que ces molécules prosthétiques sont le plus souvent reconnues comme toxiques pour les organismes vivant.
Les hydrogénases à fer
Elles ne sont présentes que chez les eubactéries et les eucaryotes. Les structures 3D des Fe-hydrogénases fonctionnelles ont été résolues presque simultanément chez deux bactéries anaérobies : D. desulfuricans [1] et C. pasteurianum [2]. Les structures de ces enzymes sont assez différentes mais elles possèdent toutes deux des clusters [Fe-S] capables de drainer des électrons entre la surface et le site actif profondément enfoui dans la protéine. Le site actif nommé cluster-H se compose d'un cluster [4Fe-4S] lié via une cystéine pontante à un cluster dinucléaire à fer (cf Fig. 2). Les atomes de fer de ce cluster dinucléaire possèdent des ligands cyanures et carbonyles et sont reliés par un ligand prosthétique pontant de type [1, 3-propanedithiolate]. L'analyse des liaisons hydrogènes entre ce ligand et la cavité mais aussi l'intuition du cristallographe peuvent laisser penser que l'atome central serait un atome d'azote (le ligand pontant serait alors la dithiométhylamine). La nature de l'atome central est toujours controversée; des résultats récents suggèrent qu'il pourrait s'agit d'un oxygène (le ligand pontant serait le dithiométhyléther) [3].
Des hydrogénases à Fe fonctionnellement productrices d'H2 ne sont aujourd'hui trouvées que chez les organismes de métabolisme anaérobie. Par contre, les recherches systématiques dans les banques de données ont mis en évidence la présence de gènes codant des protéines homologues chez les eucaryotes de métabolisme aérobie (champignon, plantes et animaux) [4]. La fonction de ces protéines chez les eucaryotes aérobies n'est pas encore totalement élucidée, mais on peut exclure une activité de type hydrogénase, aucune production d'H2 n'ayant été observée chez les eucaryotes aérobies. Ce sont des protéines liant des clusters Fe/S, en tout cas chez la levure et les végétaux [5][6]. Chez Saccharomyces cerevisiæ, la protéine ScNar1p serait impliquée dans la maturation des protéines cytosoliques et nucléaires à Cluster Fe/S [7]. Chez l'homme, Il existe deux gènes codant des Hydrogénases like. Le premier gène code une protéine appelée IOP1, impliquée dans la régulation de la dégradation de HIF1[8] et la maturation des protéines à cluster Fs/S chez l'homme[9]. Le deuxième gène code une protéine appelée IOP2, anciennement NARF qui reconnait l'extrémité farnésylée et non maturée de la prélamine A [10]. Chez les plante, un seul gène est présent et l'inactivation de ce gène chez Arabidopsis thaliana montre que ce gène est impliquée dans le développement. La ligné mutante montre un phénotype nain qui est réversé quand la lignée pousse à 5% O2 [11]. Cette relation avec l'O2 a aussi été montrée chez Cænorhabditis elegans et la levure où la croissance en milieu hypoxique modérée réverse les phénotypes mutants observées.
Les hydrogénases [NiFe] et [NiFeSe]
Les hydrogénases [NiFe] sont les plus nombreuses des hydrogénases. Elles sont présentes chez de nombreux micro-organismes comme les eubactéries méthanogènes, acétogènes, fixatrices d'azote, sulfato -réductrices des cyanobactéries (algues bleues) mais également chez des archées. Il existe par contre peu d'hydrogénases [NiFeSe]. On peut classer ces deux types d'hydrogénases en quatre grands groupes selon leurs fonctions cellulaires. La comparaison des alignements de séquences et surtout de deux régions conservées (autour des cystéines du site actif et près des zones N- et C-terminales) sert à retrouver ces quatre classes. Le groupe 1 se compose des hydrogénases [NiFe] associées aux membranes et qui se servent de l'hydrogène comme source d'énergie. Le deuxième groupe se compose d'hydrogénases cytoplasmiques hétérodimériques et sont absentes chez les archées. Le troisième groupe se compose d'hydrogénases cytoplasmiques hétéromultimériques pouvant lier un cofacteur (F420, NAD ou NADP) et fonctionnent de façon réversible. Le quatrième et dernier groupe regroupe les hydrogénases associées aux membranes qui produisent de l'hydrogène. Elles sont entre 50 et 100 fois moins actives que les hydrogénases à fer en production et oxydation de l'hydrogène (jusqu'à 1000 cycles catalytiques par seconde).
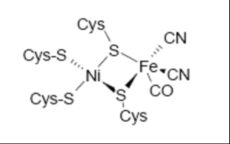
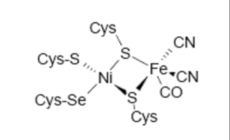
Les hydrogénases [NiFe] sont caractérisées par un site actif hétérobimétallique contenant un atome de fer et un atome de nickel. Des structures cristallographiques de ces enzymes sont connues pour cinq organismes et sont de deux types : les hydrogénases [NiFeSe] et les hydrogénases [NiFe] à ligands carbonyles. Les hydrogénases [NiFeSe] sont présentes chez les bactéries sulfato-réductrices et peuvent être péri- ou cyto-plasmique.
Les hydrogénases [NiFe]
Ce sont les premières hydrogénases dont les structures cristallographiques ont été connues. Ce sont aussi les plus étudiées. L'hydrogénase [NiFe] de Desulvibrio (D. ) gigas [12], est une protéine périplasmique hétérodimère, composée de deux sous-unités de 60 et 28 kDa. Elle possède trois clusters [Fe-S] : un cluster [3Fe-4S]1+/0 et deux clusters [4Fe-4S]2+/1+. Ils sont repartis de façon presque linéaire dans la petite sous-unité sur une longueur de 12 Å. Le cluster le plus proche du site actif se situe à 13 Å du site actif et est nommé cluster proximal ou cluster-p. Le cluster le plus éloigné du site actif (cluster distal ou cluster-d) se situe presque à la surface de la protéine. Ces clusters forment par conséquent un «chemin» pour les électrons, entre un donneur extraprotéique et le site actif. Les hydrogénases [NiFe] posséderaient un atome de magnésium dans le domaine C-terminal. D'autre part, un canal hydrophobe [13] permet la circulation d'hydrogène de l'extérieur jusqu'au site actif et plus exactement près d'un site terminal vacant du nickel. Le site actif comprend un atome de nickel coordiné par quatre cystéinates formant un tétraèdre fortement distordu (cf Fig. 4 et Fig. 6). Deux de ces cystéinates coordinent aussi un atome de fer. Cet atome de fer possède aussi deux ligands cyanures et un ligand carbonyle. Les ligands cyanures sont en interaction hydrogène avec les chaînes latérales de résidus de la cavité. Un site de coordination sur le fer est par conséquent vacant et pour compléter la sphère de coordination du fer, un autre ligand peut être présent. De récents résultats cristallographiques suggèrent la présence d'un ligand oxygéné hydroxyde ou hydropéroxyde, pontant entre le nickel et le fer quand la protéine est oxydée. D'autres résultats cristallographiques et électrochimiques suggèrent que ce ligand pourrait aussi être un sulfure.
Hydrogénases [NiFeSe]
Les hydrogénases [NiFeSe] forment une sous-classe des hydrogénases [NiFe]. Elles contiennent un atome de sélénium par protéine. L'hydrogénase périplasmique de D. baculatum a été cristallisée. C'est un hétérodimère comprenant deux sous unités de 26 et 49 kDa. Trois clusters [4Fe-4S] sont localisés dans la petite sous unité, tandis que la grosse sous unité ne contient "que" le site actif. Il ressemble énormément à celui des hydrogénases [NiFe]. L'originalité principale de cette enzyme est le remplacement d'une cystéine terminale par une sélénocystéine ligand du site actif. Les sélénocystéinates pourraient plus aisément se protoner que les cystéinates. Cela expliquerait les différences de réactivité. Dans le site actif de l'hydrogénase cristallisée, la distance entre le nickel et le fer est de 2, 5 Ǻ. Les hydrogénases [NiFe] posséderaient un atome de magnésium dans le domaine C-terminal. Pour les hydrogénases [NiFeSe], cet atome serait remplacé par un atome de fer.
Les hydrogénases sans cluster fer soufre
Ce ne sont pas à propoment parler des hydrogénases car elles n'utilisent pas de protons pour produire de l'hydrogène. Cependant, les nombreuses similitudes avec les hydrogénases lui conférent cette expression. Longtemps nommées hydrogénases sans métal (metal free hydrogenases), elles furent renommées en 2000 hydrogénases sans cluster [Fe-S] suite à la découverte d'un motif à fer au sein du cofacteur de cette enzyme. Ce fer est non-hémique et possède deux ligands carbonyles [14]. Le cofacteur s'inactive à la lumière en perdant le motif fer carbonyle qui lui est lié [15].
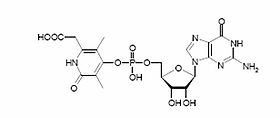
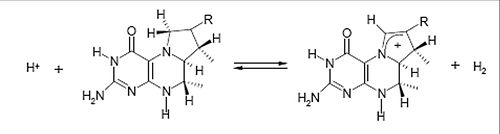
Elles sont aussi connues sous le nom de Hmd pour H-2-forming methylentetrahydromethanopterin dehydrogenase. Seuls certaines archées méthanogénes en possédent. Ces hydrogénases différent beaucoup des deux autres car elles ne contiennent pas de clusters [Fe-S] et ne possèdent pas la même réactivité. En effet, elles catalysent réversiblement la réaction de réduction du <i>N</i><sub>5</sub>, <i>N</i><sub>10</sub>-méthényltétrahydrométhanopterine en <i>N</i><sub>5</sub>, <i>N</i><sub>10</sub>-méthénylénetétrahydrométhanopterine en présence d'hydrogène. Cela correspond à un transfert d'hydrure sur le substrat ainsi qu'à la libération d'un proton en solution. Ces hydrogénases ne sont pas capables de catalyser la réduction du méthylviologène par H2, ni de catalyser l'échange des protons de H2 avec le deutérium de l'eau lourde. C'est pour cela que ce ne sont pas des hydrogénases à proprement parler. Cependant, leur capacité à utiliser l'hydrogène leurs valent l'appellation "hydrogénase".
L'activité de ces enzymes dépend fortement du pH. Un pH basique facilite la formation de methenyl-H4MPT+, tandis qu'un pH acide et la présence d'hydrogène facilite la formation de methylene-H4MPT. Par exemple la réaction de déhydrogénation peut se faire avec une vitesse maximale de 2700 μmol/min/mg de protéine pour Methanopyrus kandleri à pH inférieur à 4, 5 à plus de 90°C.
References
- Adams, M. W. W. and Stiefel, E. I., «Biological hydrogen production : Not so elementary», dans Science, vol. 282, 1998, p. 1842–1843
- Florin, L., Tsokoglou, A. and Happe, T., «A novel type of iron hydrogenase in the green alga Scenedesmus obliquus is linked to the photosynthetic electron transport chain», dans J. Biol. Chem. , vol. 276, 2001, p. 6125–6132
- Frey, M., «Hydrogenases : hydrogen-activating enzymes», dans ChemBioChem, vol. 3, 2002, p. 153–160
- Lyon, E. J., Shima, S., Bœcher, R., Thauer, R. K., Grevels, F. -W., Bill, E., Roseboom, W. and Albracht, S. P. J., «Carbon monoxide as an intrinsic ligand to iron in the active site of the iron-sulfur-cluster-free hydrogenase H2-forming methylenetetrahydromethanopterin dehydrogenase as revealed by infrared spectroscopy», dans J. Am. Chem. Soc. , vol. 126, 2004, p. 14239–14248
- Nicolet, Y., Lemon, B. J., Fontecilla-Camps, J. C. and Peters, J. W., «A novel FeS cluster in Fe-only hydrogenases», dans Trends Biochem. Sci. , vol. 25, 2000, p. 138–143
- Vignais, P. M., Billoud, B. and Meyer, J., «Classification and phylogeny of hydrogenases», dans FEMS Microbiol. Rev. , vol. 25, 2001, p. 455–501
Notes
- ↑ Nicolet, Y., Piras, C., Legrand, P., Hatchikian, E. C. and Fontecilla-Camps, J. C., «Desulfovibrio desulfuricans iron hydrogenase : the structure shows unusual coordination to an active site Fe binuclear center», dans Structure Fold. Des. , vol. 7, 1999, p. 13–23
- ↑ Peters, J. W., Lanzilotta, W. N., Lemon, B. J. and Seefeldt, L. C., «X-ray crystal structure of the Fe-only hydrogenase (CpI) from Clostridium pasteurianum to 1.8 Å resolution», dans Science, vol. 282, 1998, p. 1853–1858
- ↑ «Dithiomethylether as a ligand in the hydrogenase h-cluster», dans J. Am. Chem. Soc. , vol. 130, 2008, p. 4533 [lien DOI]
- ↑ Hackstein, J. H., «Eukaryotic Fe-hydrogenases -- old eukaryotic heritage or adaptive acquisitions?», dans Biochem Soc Trans., vol. 33, 2005, p. 47–50
- ↑ Balk, J., Pierik, A. J., Netz, D. J., Mühlenhoff, U., Lill, R., «The hydrogenase-like Nar1p is essential for maturation of cytosolic and nuclear iron-sulphur proteins. », dans EMBO J., vol. 23 (10), 2004, p. 2105–15
- ↑ Cavazza, C., Martin, L., Mondy, S., Gaillard, J., Ratet, P., Fontecilla-Camps, J. C., «The envisageable role of an [FeFe]-hydrogenase-like protein in the plant responses to changing atmospheric oxygen levels. », dans J Inorg Biochem., vol. 102 (5-6), 2008, p. 1359–65
- ↑ Balk, J., Pierik, A. J., Netz, D. J., Mühlenhoff, U., Lill, R., «The hydrogenase-like Nar1p is essential for maturation of cytosolic and nuclear iron-sulphur proteins. », dans EMBO J., vol. 23 (10), 2004, p. 2105–15
- ↑ Huang, J., Song, D., Flores, A., Zhao, Q., Mooney, S. M., Shaw, L. M., Lee, F. S., «IOP1, a novel hydrogenase-like protein that modulates hypoxia-inducible factor-1alpha activity», dans Biochem J., vol. 401 (1), 2007, p. 341–52
- ↑ Song, D., Lee, F. S., «A role for IOP1 in mammalian cytosolic iron-sulfur protein biogenesis. », dans J Biol Chem., vol. 283 (14), 2008, p. 9231–8
- ↑ Barton, R., Worman, H. J., «Prenylated prelamin A interacts with Narf, a novel nuclear protein. », dans J Biol Chem., vol. 274 (42), 1999, p. 30008–18
- ↑ Cavazza, C., Martin, L., Mondy, S., Gaillard, J., Ratet, P., Fontecilla-Camps, J. C., «The envisageable role of an [FeFe]-hydrogenase-like protein in the plant responses to changing atmospheric oxygen levels. », dans J Inorg Biochem., vol. 102 (5-6), 2008, p. 1359–65
- ↑ Volbeda, A., Charon, M. -H., Piras, C., Hatchikian, E. C., Frey, M. and Fontecilla-Camps, J. C., «Crystal structure of the nickel-iron hydrogenase from Desulfovibrio gigas», dans Nature, vol. 373, 1995, p. 580–587
- ↑ F. Leroux et al., «Experimental approaches to kinetics of gas diffusion in hydrogenase», dans Proc Natl Acad Sci U S A. , vol. 105, 2008, p. 11188 [lien DOI]
- ↑ «The crystal structure of [Fe]-hydrogenase reveals the geometry of the active site. », dans Science, vol. 321, 2007, p. 572 [lien DOI]
- ↑ Shima S, Lyon EJ, Sordel-Klippert M, Kauss M, Kahnt J, Thauer RK, Steinbach K, Xie X, Verdier L, Griesinger C., «The cofactor of the iron-sulfur cluster free hydrogenase hmd : structure of the light-inactivation product. », dans Angew Chem Int Ed Engl. , vol. 43, 2004, p. 2547 [lien DOI]
Liens externes
- 2B0J - PDB Structure de l'apœnzyme hydrogénase sans cluster fer soufre de Methanothermococcus jannaschii
- 1HFE - PDB Structure de l'hydrogénase à fer seul de Desulfovibrio desulfuricans
- 1C4A - Structure PDB de l'hydrogénase à fer seul de Clostridium pasteurianum
- 1UBR - Structure PDB de l'hydrogénase [NiFe] de Desulfovibrio vulgaris
- 1CC1 - Structure PDB de l'hydrogènase [NiFeSe] de Desulfomicrobium baculatum
- Animation- (en) Proposition de mécanisme catalytique pour les hydrogènases [NiFe]
- [1] - Thèse dont une partie de l'introduction décrit en détail les hydrogènases
Recherche sur Google Images : |
|
"et les hydrogénases à fer." L'image ci-contre est extraite du site www-dsv.cea.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (550 x 333 - 120 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité