Superoxyde dismutase
La superoxyde dismutase, est une métalloprotéine avec une activité enzymatique : la catalyse de la dismutation du superoxyde en oxygène et peroxyde d'hydrogène.
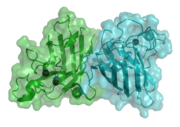
La superoxyde dismutase (SOD, numéro EC : 1.15.1.1), est une métalloprotéine avec une activité enzymatique : la catalyse de la dismutation du superoxyde en oxygène et peroxyde d'hydrogène. Pour cette raison, cette enzyme est une partie importante du dispositif de défense contre les radicaux libres. Elle est présente dans presque l'ensemble des organismes aérobies. Une des rarissimes exceptions est Lactobacillus plantarum et les Lactobacillus apparentés, qui n'en possèdent pas et utilisent un mécanisme de défense différent.
Cofacteurs métalliques
Il existe quatre types de superoxydes dismutases selon les ions cofacteurs : cuivre et zinc ; manganèse ; fer ; nickel.
Réaction catalytique
La dismutation du superoxyde catalysée par les SOD peut être rédigée avec deux demi-réactions suivantes :
- M (n+1) + − SOD + O2− → Mn+ − SOD + O2
- Mn+ − SOD + O2− + 2H+ → M (n+1) + − SOD + H2O2.
où M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
Considérant ces équations, tout élément métallique impliqué dans un couple redox monoélectronique, dont le potentiel d'oxydo-réduction à pH physiologique est compris entre les potentiels[1] des réactions d'oxydation (-0, 33V, en dioxygène) et de réduction (+0, 89V en peroxyde d'hydrogène) du superoxyde peut être employé au sein d'une SOD. Quoique ces cations métalliques (excepté le fer (II) ) ne possèdent pas un potentiel approprié à l'état libre, les ligands (i. e. histidine, cystéine, aspartate) du centre métallique influent sur le potentiel redox du cation, donnant la possibilité ainsi la catalyse de la réaction de dismutation du superoxyde.
Dans l'enzyme à cuivre et zinc, le zinc n'a pas de rôle catalytique.
Les SOD dans les êtres vivants
La localisation chez les êtres vivants des différents types de SOD est discutée dans cette section.
Le cytosol de presque l'ensemble des cellules eucaryotes contient la forme à cuivre-zinc de la SOD (CuZn-SOD). (A titre d'exemple, la CuZn-SOD qui est disponible comme produit commercial est purifiée à partir des globules rouges bovins : PDB 1SXA, EC 1.15.1.1). L'enzyme à Cu-Zn est un homodimère de poids moléculaire de 32 500 daltons.
Les deux sous-unités interagissent essentiellement par des mécanismes hydrophobes et électrostatiques. Les ligands du cuivre et du zinc sont des chaînes latérales d'histidine.
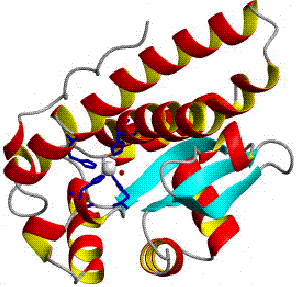
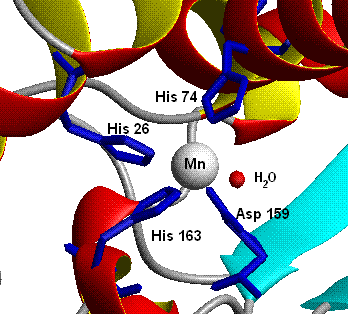
Les mitochondries des cellules eucaryotes, et énormément de bactéries (par exemple E. coli) contiennent une SOD à manganèse (Mn-SOD). (A titre d'exemple, le Mn-SOD mitochondriale humaine : PDB 1N0J, EC 1.15.1.1). Les ligands du manganèse sont trois chaines latérales d'histidine, une chaine latérale d'aspartate et une molécule d'eau ou un ion OH- suivant l'état d'oxydation du manganèse (respectivement II et III).
E. coli et d'autres bactéries contiennent aussi la forme à fer de l'enzyme. Certaines bactéries contiennent la Fe-SOD d'autres la Mn-SOD, et certaines contiennent les deux ou des SOD cambialistiques pouvant fonctionner soit avec le Fe, soit avec le manganèse selon la biodisponibilité des cations de ces métaux. Fe-SOD d'E. coli : PDB 1ISA, EC 1.15.1.1). Les sites actifs de la Mn-SOD et de la Fe-SOD contiennent le même type de chaînes latérales et ont presque la même structure.
Être humain
Chez l'être humain, il y a cœxistence de trois formes de SOD. Un type de CuZn-SOD (SOD1) se trouve dans le cytoplasme, la Mn-SOD (SOD2) dans les mitochondries et un deuxième type de CuZn-SOD (SOD3) est extracellulaire. Les gènes correspondant aux SOD1-3 se trouvent respectivement dans les chromosomes 21, 6 et 4 (21q22.1, 6q25.3 et 4p15.3-p15.1).
Physiologie
Le radical-anion superoxyde O2-) dismute spontanément en O2 et H2O2 mais, dans les conditions physiologiques, la vitesse de cette réaction bimoléculaire est faible et le temps de vie du superoxyde est suffisamment long pour qu'il puisse soit oxyder des composants des macromolécules biologiques (acides nucléiques, protéines …), soit générer d'autres espèces réactives oxygénées énormément plus toxiques que le superoxyde lui-même (telles que le péroxynitrite en réagissant avec NO ou le radical hydroxyle en réagissant avec le H2O2).
Pour éviter la toxicité du superoxyde et de ses dérivés, l'évolution a permis d'obtenir des SOD hautement efficaces. La CuZn-SOD a la plus grande constante de vitesse catalytique réputée pour une enzyme, kcat=∼109 M-1 s-1). La réaction entre la CuZn-SOD et le superoxyde n'est limitée que par la diffusion du superoxyde vers le site actif de l'enzyme. Les autres SOD sont un peu moins efficaces (kcat=∼108 M-1 s-1. )
Dans les conditions normales, la SOD réduit efficacement la concentration de superoxyde dans les tissus vivants, empêchant la toxicité du superoxyde de se manifester.
Mutations
L'importance physiologique des SOD a été mise en évidence avec études réalisées sur des lignées de souris génétiquement modifiées dans lesquelles un des types de SOD a été inactivé.
Effets des mutations :
- Les souris dépourvues de SOD1 (CuZn-SOD cytosolique) développent une grande quantité de pathologies parmi lesquelles des cancers du foie, une accélération de la perte de masse musculaire avec l'âge, une incidence précoce de la cataracte et une espérance de vie réduite.
- Les souris dépourvues de SOD2 (Mn-SOD) meurent quelques jours après l'apparition dans des conditions de stress oxydant massif.
- Les souris dépourvues de SOD3 ne présentent, par contre, aucune anomalie visible.
Utilisation cosmétique
Une étude[2] décrit une utilisation envisageable de la CuZn-SOD pour diminuer le stress oxydant subi par la peau, par exemple pour diminuer la fibrose causée par les traitements radiologique du cancer du sein. Cependant, cette étude n'est que préliminaire, à cause de limitations du protocole expérimental (pas de double aveugle, ni de groupe placébo).
Voir aussi
Notes et références
- ↑ potentiels à pH=7, 25°C, et contre l'électrode standard à hydrogène
- ↑ F. Campana, Topical superoxide dismutase reduces post-irradiation breast cancer fibrosis, J. Cell. Mol. Med., 2004, 8 (1), 109-116. Texte en accès libre - PDF 333kB
Bibliographie
- (en) Barry Halliwell & John Gutteridge, Free Radicals in Biology and Medicine, Oxford University Press, USA, 1999.
Liens externes
- 147450 (en) (SOD1), 147460 (en) (SOD2), 185490 (en) (SOD3) and 105400 (en) (ALS)
- (en) The ALS Online Database
- (en) Un aperçu de la littérature scientifique concernant les SOD
- Discussion de rôle des SOD dans le vieillissement.
Recherche sur Google Images : |
|
"La SuperOxyde Dismutase est" L'image ci-contre est extraite du site doriance.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (349 x 380 - 13 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité