Réaction d'oxydo-réduction
Une réaction d'oxydo-réduction est une réaction chimique durant laquelle se produit un transfert d'électrons. L'atome qui capte les électrons est nommé «oxydant» ; celui qui les cède, «réducteur».
Une réaction d'oxydo-réduction est une réaction chimique durant laquelle se produit un transfert d'électrons. L'atome qui capte les électrons est nommé «oxydant» ; celui qui les cède, «réducteur».
Les réactions d'oxydo-réductions forment une grande famille comprenant de nombreuses réactions chimiques, dans la mesure où elles interviennent dans les combustions, certains dosages métallurgiques, la corrosion des métaux, l'électrochimie ou la respiration cellulaire. Ces réactions jouent surtout un rôle essentiel en biologie, dans la transformation de l'oxygène au sein des corps vivants. Elles sont aussi massivement utilisées par l'industrie humaine, à l'exemple de l'obtention de la fonte à partir de minerais composés d'oxyde de fer, par réduction, puis de fer et d'acier à partir de la fonte, par oxydation.
Cette variété s'explique par la mobilité, la légèreté et l'omniprésence dans l'ensemble des formes de la matière de l'électron.
Suite à des expériences avec le mercure, Lavoisier met en évidence en 1772 le rôle du dioxygène dans certaines réactions d'oxydo-réduction. Il pose les premières définitions :
- L'oxydation veut dire «combinaison avec l'oxygène». Par exemple :
- Une réduction est «l'extraction d'un métal de son oxyde», définition déjà utilisée en métallurgie. Par exemple :
Dans le langage familier, l'oxydation est la réaction chimique dans laquelle un composé se combine avec un ou plusieurs atomes d'oxygène. Comme l'oxydation du fer qui produit la rouille :
- 4Fe + 3O2 → 2 Fe2O3.
Ce n'est qu'au XXe siècle, après la découverte de l'électron (J. J. Thomson, 1897) et l'introduction du modèle atomique de Bohr (1913) que les réactions chimiques ont été réexaminées à la lumière de ces nouveaux modèles et que des similitudes observées permirent de dégager progressivement le concept actuel d'oxydo-réduction qui s'exprime en termes de transferts d'électrons.
Pour favoriser l'étude des réactions, on utilise un outil qui associe (quelquefois abstraitement) à chaque atome d'un composé un nombre d'oxydation (n. o. ) qui symbolise la valeur de la charge portée. (Fe2+ a un nombre d'oxydation de 2. )
- Une oxydation est une perte d'électrons (donc une augmentation du n. o., les électrons étant chargés négativement). Par exemple :
- Cu → Cu2+ + 2 e-
- Ce don d'électrons ne se produit que s'il existe un corps susceptible de les accepter.
- Le phénomène inverse (acceptation des électrons) est nommé la réduction.
- Une réduction est un gain d'électrons (donc une diminution du n. o., les électrons étant chargés négativement). Par exemple :
- I2 + 2 e- → 2 I-
Ainsi, les «combinaisons avec l'oxygène» ne sont qu'un cas spécifique des réactions d'oxydo-réduction. Voici deux réactions avec le cuivre :
- Cu + ½ O2 → CuO
- Cu2+ + 2 Cl- → CuCl2
La première combine le cuivre et le dioxygène alors que la seconde combine le cuivre et l'ion chlorure. L'ion chlorure et le dioxygène ont un point commun : ce sont des éléments plus électronégatifs que le cuivre.
L'oxydation d'un corps s'accompagne toujours de la réduction d'un autre (les électrons ne peuvent pas se circuler seuls et sont obligatoirement captés), on parle d'une réaction d'oxydo-réduction. L'oxydation est une demi-réaction de l'oxydo-réduction et la réduction est l'autre demi-réaction.
Dans une oxydo-réduction,
- l'élément qui perd un ou des électron (s) est nommé «réducteur»,
- l'élément qui capte un ou des électron (s) est nommé «oxydant».
Le réducteur s'oxyde (réaction d'oxydation), l'oxydant se réduit (réaction de réduction). L'oxydo-réduction se compose par conséquent de deux demi-réactions : une oxydation et une réduction.
- Oxydation
réducteur (1) = oxydant (1) + ne- (les flèches n'apparaissent que si la réaction est totale, lorsque K > 10 000) - Réduction
oxydant (2) + ne- = réducteur (2) - Oxydo-réduction («somme» de l'oxydation et de la réduction)
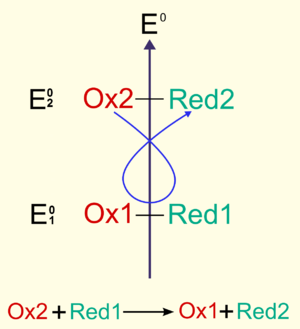
oxydant (2) + réducteur (1) → oxydant (1) + réducteur (2)
Exemple :
- Ce4+ + e- = Ce3+
- Fe2+ = Fe3+ + e-
- d'où la réaction bilan :
- Ce4+ + Fe2+ → Ce3+ + Fe3+
Un réducteur oxydé (=forme oxydée) est un oxydant, et un oxydant réduit (=forme réduite) est un réducteur. On définit ainsi le couple oxydant-réducteur (anciennement nommé «couple redox») qui se compose de l'oxydant et du réducteur conjugué (l'oxydant réduit). On le note sous la forme : oxydant/réducteur.
Certain composés chimiques peuvent se comporter autant en oxydant qu'en réducteur. C'est surtout le cas de l'eau oxygénée, dont on dit qu'elle se dismute, et qui donc ne peut être conservée longtemps :
- H2O2 = 2H+ + O2 + 2e- (oxydation)
- H2O2 + 2H+ + 2e- = 2H2O (réduction)
Soit au final :
- 2H2O2 → 2H2O + O2 (oxydo-réduction)
On a par exemple les couples oxydant-réducteur Cu2+/Cu et Zn2+/Zn, qui donnent la réaction en solution aqueuse :
- Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s) (oxydo-réduction)
Cette réaction peut se décomposer en une réduction et une oxydation :
- Zn (s) = Zn2+ (aq) + 2e- (oxydation)
- Cu2+ (aq) + 2e- = Cu (s) (réduction)
Les deux demi-réactions d'oxydation et de réduction peuvent réellement être scindées occasionnellement(c'est-à-dire qu'elles ne se produisent pas au même lieu), ce qui sert à générer un courant électrique (c'est ce qui se passe dans les piles électriques). Dans les autres cas, par exemple dans l'exemple donné, elles n'ont qu'un intérêt formel (les électrons libres n'existent pas dans l'eau).
Équilibre des équations de réaction
Une réaction d'oxydo-réduction doit être équilibrée pour assurer un décompte exact des électrons en jeu. Il y a quelquefois des réactions complexes qui nécessitent d'équilibrer les cœfficients stœchiométriques des demi-équations. Il faut quelquefois ajouter des molécules ou des ions en solution (en fonction du milieu) pour équilibrer.
Par exemple pour la réaction entre le permanganate de potassium (couple MnO4-/Mn2+) et une solution de fer (couple Fe3+/Fe2+) :
- (Fe2+ = Fe3+ + e-) x5
- MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
- MnO4- + 8H+ + 5Fe2+ → Mn2+ + 4H2O + 5Fe3+
Équilibrer la réaction redox, c'est aussi combiner linéairement les demi-réactions (oxydation et réduction) de manière que le nombre d'électrons donnés soit précisément le nombre d'électrons acceptés : la réaction redox est un échange strict d'électrons (thermodynamiquement favorable).
Par exemple :
- Fe = Fe3+ + 3e- ;
- O2 + 4 e- → 2 O2-
Dans le cas présent, il s'agit de trouver le plus petit commun multiple de 3 et de 4, soit 12, de façon à avoir un bilan d'échange strict : il faut par conséquent combiner 4 fois la première demi-réaction (le fer va apporter 12 électrons) avec 3 fois la seconde demi-réaction (le dioxygène va accepter 12 électrons), soit :
- 4 Fe + 3O2 → 4 Fe3+ + 6 O2-
C'est l'échange d'électrons qui forme le phénomène redox.
Par la suite, il se produit une attraction électrostatique : les charges positives et les charges négatives s'attirent et se disposent de façon à former un cristal ionique neutre :
- 4 Fe3+ + 6 O2- → 2 Fe2O3
Ceci n'est pas une réaction chimique à proprement parler, mais une réécriture correspondant à l'attraction statique dans le cristal ionique (une hématite).
Le caractère «oxydant» ou «réducteur» est relatif dans le cadre d'une réaction chimique. Un élément réducteur dans une réaction peut être oxydant dans une autre. Mais il est envisageable de construire une échelle de force oxydante (ou, dans l'autre sens, de force réductrice) : c'est le potentiel d'oxydo-réduction, qui se mesure en volt. En outre, ce potentiel peut dépendre du contexte chimique et surtout du pH, et même du contexte physique : les effets de la lumière sont mis à profit autant par la nature dans la photosynthèse, que par l'homme dans la photographie.
Principaux couples d'oxydants-réducteurs
Tous les couples d'oxydant-réducteur s'écrivent sous la forme Ox/Red. Ils sont classés de l'oxydant le plus fort au plus faible, ou du réducteur le plus faible au plus fort, et on indique la valeur de leur potentiel en volt (à 25 °C ainsi qu'à 101, 3 kPa).
| Oxydant/Réducteur | E0 (V) |
|---|---|
| F2 / F- | +2, 87 |
| S2O82- / SO42- | +2, 01 |
| H2O2 / H2O | +1, 77 |
| MnO4- / MnO2 | +1, 69 |
| MnO4- / Mn2+ | +1, 51 |
| Au3+ / Au | +1, 50 |
| PbO2 / Pb2+ | +1, 45 |
| Cl2 / Cl- | +1, 36 |
| Cr2O72- / Cr3+ | +1, 33 |
| MnO2 / Mn2+ | +1, 23 |
| O2 / H2O | +1, 23 |
| Br2 / Br- | +1, 08 |
| NO3- / NO | +0, 96 |
| Hg2+ / Hg | +0, 85 |
| NO3- / NO2- | +0, 84 |
| Ag+ / Ag | +0, 80 |
| Fe3+ / Fe2+ | +0, 77 |
| O2 / H2O2 | +0, 68 |
| I2 / I- | +0, 62 |
| Cu2+ / Cu | +0, 34 |
| CH3CHO / C2H5OH | +0, 19 |
| SO42- / SO2 | +0, 17 |
| S4O62- / S2O32- | +0, 09 |
| H+ / H2 | +0, 00 |
| CH3CO2H / CH3CHO | -0, 12 |
| Pb2+ / Pb | -0, 13 |
| Sn2+ / Sn | -0, 14 |
| Ni2+ / Ni | -0, 23 |
| Cd2+ / Cd | -0, 40 |
| Fe2+ / Fe | -0, 44 |
| Zn2+ / Zn | -0, 76 |
| Al3+ / Al | -1, 66 |
| Mg2+ / Mg | -2, 37 |
| Na+ / Na | -2, 71 |
| K+ / K | -2, 92 |
Le corps humain se sert aussi des réactions d'oxydo-réduction pour des processus de biosynthèse, telle la biosynthèse des acides gras, la chaîne respiratoire mitochondriale ou la néoglucogenèse. Les couples les plus utilisés sont surtout :
- Henry Guerlac (1961) Lavoisier — the essentiel year : The background and origin of his first experiments on combustion in 1772
- Schüring, J., Schulz, H. D., Fischer, W. R., Böttcher, J., Duijnisveld, W. H. (editors) (1999). Redox : Fundamentals, Processes and Applications, Springer-Verlag, Heidelberg, 246 pp. ISBN 978-3540665281 (pdf pesant 3, 6 Mo)
Recherche sur Google Images : |
|
"réaction d'oxydo-réduction" L'image ci-contre est extraite du site fr.wikipedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (300 x 329 - 26 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité