Hydrolyse
L'hydrolyse d'une substance est sa décomposition par l'eau grâce aux ions H3O+ et HO- provenant de la dissociation de l'eau.
Recherche sur Google Images :
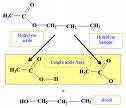
Source image : chimix.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Réaction chimique de l'eau sur une substance, se traduisant par la rupture d'une liaison. C'est la réaction inverse de la formation... (source : b-harmony)
- Clivage d'un liaison avec addition d'eau (-H est ajouté à l'une des molécules résultant du clivahe et -OH à l'autre). (source : pagesperso-orange)
L'hydrolyse d'une substance est sa décomposition par l'eau grâce aux ions H3O+ et HO- provenant de la dissociation de l'eau. A titre d'exemple, l'hydrolyse du saccharose donne du glucose et du fructose, ou encore, l'hydrolyse d'un ester donnera un alcool et un acide.
L'hydrolyse est moins connue que sa réaction inverse, l'estérification, qui est énormément plus intéressante d'un point de vue industriel (production d'ester) tandis que l'hydrolyse ne produit que des acides et des alcools.
Pour des substances organiques telles que les protéines, une hydrolyse équivaut à la coupure des liaisons peptidiques entre les différents acides aminés qui les forment. Les acides aminés sont coupés par les enzymes.
On a R1-COO-R2 + H2O ↔ R2-OH (alcool) + R1-COOH (acide) .
À titre d'exemple, lors de la cuisson d'une viande, le collagène ne peut se transformer en gélatine qu'en présence d'eau.
De nombreuses molécules peuvent être hydrolysées. Parmi les fonctions hydrolysables, nous trouvons les esters, les acétals (présents dans les polysaccharides) et les amides (présents dans les protéines)
Taux de conversion d'une hydrolyse
L'hydrolyse d'un ester par de l'eau est une réaction lente et limitée. En effet, il se forme des produits qui sont des acides et des alcools, qui eux-mêmes réagissent ensemble dans le milieu réactionnel pour former à leur tour de l'ester et de l'eau. Le taux de conversion d'une hydrolyse d'ester lors de l'introduction des réactifs en quantités stœchiométriques est de l'ordre de 33 % lorsqu'il forme un alcool primaire, 40 % pour un secondaire et 95 % pour un tertiaire. Un excès d'eau déplace logiquement cet équilibre vers la formation de l'alcool.
L'hydrolyse basique est , comme son nom l'indique, une réaction d'hydrolyse. Mais, au contraire de une hydrolyse classique, l'eau est remplacée le plus souvent par de la soude ou toute autre solution contenant des ions hydroxyde (comme de l'hydroxyde de potassium par exemple), d'où le nom d'hydrolyse basique car la réaction d'hydrolyse a lieu en milieu basique. L'équation générale d'une réaction d'hydrolyse basique est la suivante :
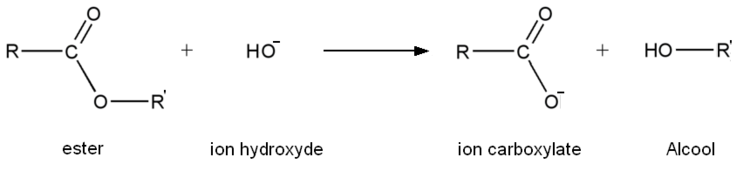
L'ion carboxylate (au contraire de l'acide carboxylique constitué lors d'une hydrolyse classique) est sans effet sur l'alcool de sorte que la réaction inverse d'estérification n'a pas lieu. Donc une transformation d'hydrolyse basique est totale au contraire de une hydrolyse classique. Une hydrolyse basique est rapide à chaud.
Une application de l'hydrolyse basique est la formation de savons. En effet, les réactions de saponification à l'origine des savons ne sont autres que des réactions d'hydrolyse basique à partir de corps gras (qui sont des triesters du glycérol). Les savons sont obtenus par précipitation de l'ion carboxylate obtenu lors de la saponification avec sodium ou de potassium. Les savons sont des carboxylates de sodium ou de potassium.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité